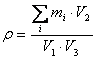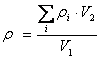|
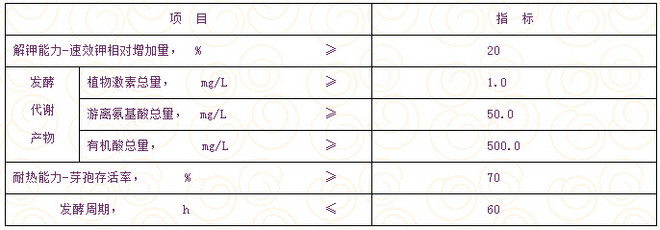
硅酸盐细菌菌种 NY 882—20041 范围 本标准规范了农用硅酸盐细菌菌种的特征、要求、检验方法、评价方法以及菌种的纯化、复壮和保藏。 本标准适用于农用微生物菌剂和微生物肥料生产中使用的硅酸盐细菌菌种。 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB/T 17419-1998 含氨基酸叶面肥料 NY/T 301-1995 有机肥料速效钾的测定 NY/T 798-2004 复合微生物肥料 3 术语 硅酸盐细菌菌种 Silicate-Dissolving Bacteria Culture 是指一类在土壤中能通过自身的生命活动,分解硅铝酸盐类矿物,释放钾素营养,改善植物的营养条件,并具备生产应用性能的细菌纯培养物。 4 菌种特征 硅酸盐细菌菌种包括胶质芽孢杆菌(Bacillus mucilaginosus)和土壤芽孢杆菌(Bacillus edaphicus)两个种。 4.1 细胞形态 营养体:粗长杆状,两端钝圆,革兰氏染色反应不定,产生聚β-羟基丁酸盐(PHB)颗粒。在培养基 A.1 上(参见附录 A )菌体大小为(1.0 ~ 1.2)× (2.5 ~ 7.0)μm ,菌体周围有厚荚膜。 芽孢:壁厚,椭圆形,中生或近端生,芽孢囊不膨大或微膨大。 4.2 菌落形态 在 A.1 培养基平板上:菌落圆形,无色,隆起,胶质粘稠,透明或半透明,边缘整齐。 4.3 生物学特征 好氧或兼性厌氧生长,水解淀粉,接触酶反应阳性,氧化酶和卵磷脂酶反应阴性,在无氮培养基(参见附录A.2)上生长良好,生长温度10 ℃ ~ 45 ℃。 5 要求 5.1 菌种要求纯培养物,无杂菌。 5.2 硅酸盐细菌菌种技术指标见表1。 表1 硅酸盐细菌菌种技术指标
6 检验方法 6.1 菌种纯度检验 在适宜培养基上培养,观察菌落和菌体形态,若有杂菌丢弃或对其进行纯化,纯化方法见 8.1.2 。 6.2 解钾能力的测定 速效钾相对增加量的测定方法见附录 B。 6.3 发酵代谢产物测定 6.3.1 发酵条件 在适宜培养条件下,发酵周期结束后取样测定发酵液中代谢产物的含量。以不接种的发酵培养液作对照。发酵培养基见附录 A.3 。 6.3.2 植物激素的测定 见附录 C 。 6.3.3 游离氨基酸的测定 见附录 D 。 6.3.4 有机酸的测定 见附录 E 。 6.4 芽孢存活率测定 6.4.1测定方法 菌悬液在 65 ℃ 条件下恒温 30 min 杀死营养体 ,制成芽孢悬液。芽孢悬液 80 ℃ 恒温水浴处理 10 min ,将处理前和处理后的芽孢悬液稀释涂布在适宜培养基上,适宜条件下培养 2 d ~ 4 d ,计菌落数。三次重复。活菌数测定方法应符合NY/T 798-2004中5.3.2的要求。 6.4.2芽孢存活率计算 按式(1) 计算
式中:
n0 -- 处理前芽孢悬液的菌落平均数(cfu/mL) n1 -- 处理后芽孢悬液的菌落平均数(cfu/mL) 6.5 发酵周期的检验 适宜生产条件下,当发酵液中的菌体数量达到 108 cfu / mL 以上且有 80 % 以上的营养体形成芽孢为发酵周期终止。 7 评价方法 7.1 菌株符合表1中的各项指标,可以作为优良生产菌株。 7.2 表1中其他三项符合要求,而发酵代谢产物仅两项达到要求或其中一项达到要求的两倍,也可作为生产菌株。 7.3 当硅酸盐细菌菌种用做生产液体剂型时,对耐热能力不做要求。 8 菌种纯化、复壮和保藏 8.1 菌种分离与纯化 8.1.1 分离 将土壤或其他样品制成菌悬液,稀释后涂布 A.1 培养基平板上,适宜条件下培养 2 d ~ 4 d ,挑取符合硅酸盐细菌菌种特征的菌落进行纯化。 8.1.2 纯化 在适宜的培养基上连续划线培养观察,直至菌落形态一致,镜检菌体大小整齐,无杂菌。 根据硅酸盐细菌的特征进行菌种确认。 8.2 复壮 菌种生长速度下降、菌体形态出现异常、主要功能指标下降时需要进行菌种复壮。 具体操作方法是将菌种接种在适宜的土壤或载体中,也可将菌种转接在含有土壤浸出液的培养基上 2 ~ 3 代;培养一段时间后再分离,挑取与原菌种特征一致的菌落,纯化,同时按表5.1中的要求进行测试。 8.3 菌种保藏 8.3.1 短期保藏 常用的保藏方法是斜面保藏法,挑选菌苔丰满无污染的斜面菌种置于4 ℃ ~ 8 ℃ 下保存,三个月左右转接一次。 8.3.2 长期保藏 菌种形成芽孢后进行长期保存,采用两种或两种以上的方法保存,并制备多个备份。常采用的保藏方法有:冻干管法,甘油管法,石蜡油覆盖法,砂土管法等。
附 录 A A.1 硅酸盐细菌培养基
A.2 无氮培养基(阿须贝(Ashby)培养基)
A.3 测定发酵代谢产物用发酵培养液
附 录 B B.1 原理 硅酸盐细菌能够分解硅铝酸盐矿物,将矿物态钾转变为可溶性钾为菌体自身或植物所利用,通过测定培养液中速效钾含量的相对增加量来确定菌种的解钾能力。 B.2 材料和试剂 B.2.1 材料 含钾矿石粉:钾长石,磨碎,粒径 0.075 mm 以下。 B.2.2 试剂 20% H2O2 溶液 B.3 培养液 B.3.1 种子液
B.3.2 发酵液
B.4 测定方法步骤 B.4.1 钾矿石处理 钾矿石粉用 20% HCl 溶液淋洗(酸洗,洗去速效钾和缓效钾),再用蒸馏水淋洗至中性。 B.4.2 种子液制备 挑取一环活化好的斜面菌种接入50 mL 种子培养液中,150 r/min 摇床,适宜温度下培养到对数期,菌体含量不少于 2×108cfu/ mL 。 B.4.3 发酵液制备 500 mL 三角瓶加入解钾发酵液 95 mL,高压灭菌备用。接入种子液 5 mL,同时做加入等量灭活种子液的发酵液为对照,在28 ℃、150 r/min 条件下 培养 7 d 。设置三个重复。 B.4.4 发酵液的处理 过氧化氢灰化法 将全部发酵液转入蒸发皿中,在水浴锅中浓缩至 10 mL 左右,加 2.0 mL H2O2 溶液 ,继续蒸发,并不断搅动,反复加 20% H2O2 溶液几次至粘性物质完全消化。3500 r/min 离心 10 min ,将上清液收集在 50 mL 容量瓶中,用蒸馏水定容,然后测定溶液中速效钾含量。 B.4.5 速效钾的测定 按 NY/T 301-1995 规定执行。对第6章试样的制备、第7章分析步骤中的7.1和7.3标准曲线绘制进行修改。 B.4.5.1 试样的制备 按 B.4.4 的要求执行。 B.4.5.2 分析步骤 试样溶液制备 参见NY/T 301-1995 7.1,将称取试样 5.00 g 改为吸取试样 5.00 mL 。 吸取钾标准溶液 0,1.00,2.00,3.00,4.00,5.00,7.50,10.00 mL 分别置于 8 个 50 mL 容量瓶中。加 10.00 mL 硝酸溶液,用水定容。此溶液 1 mL 中含钾(K)0,2.00,4.00,6.00,8.00,10.00,15.00,20.00 μg 的标准溶液系列。在火焰光度计上用空白溶液调节仪器零点,以标准溶液系列中的最高浓度的标准溶液调节仪器满刻度至 80 分度处,测量其他标准溶液,记录仪器示值。根据钾浓度和仪器示值绘制校准曲线或求出直线回归方程。 B.5 速效钾相对增加量 按式(2)计算
……(2) 式中: a — 速效钾相对增加量(%) ρ0 — 试样中速效钾的含量(mg/L)(未接种发酵液的对照) ρ1 — 试样中速效钾的含量(mg/L)(接种发酵液)
附 录 C C.1 原理 植物生长素赤霉素(GA3)、吲哚乙酸(IAA)和细胞分裂素玉米素(Z)、异戊烯基腺嘌呤(IPA)等嘌呤衍生物都溶于甲醇,可用甲醇提取发酵液中的植物激素。 植物生长素和细胞分裂素的分子结构不同,在反相 C18 柱上保留时间不同,调整流动相中各组分的比例,可使各组分定量分离。因此采用反相液相色谱法可对植物生长素和细胞分裂素定量测定。 C.2 试剂 乙腈:色谱纯。甲醇:优级纯并经 0.5μm 滤膜过滤。植物激素标准品:色谱纯。磷酸:优级纯。水重蒸并经 0.45μm 滤膜过滤。 植物生长素标准溶液:分别称取植物生长素标准品(赤霉素 GA3 ,吲哚乙酸 IAA)各 0.0020 g(±0.0001),用甲醇溶解并定容至 25.0 mL ; 细胞分裂素标准溶液:分别称取细胞分裂素标准品(玉米素 Z ,异戊烯基腺嘌呤 IPA 等)各 0.0040 g(±0.0001),用甲醇溶解并定容至 25.0 mL . C.3 仪器 高效液相色谱仪(HPLC),具紫外检测器。 C.4 测定方法 C.4.1 生长素 C.4.1.1 试样制备 取 10.00 mL 发酵液于 50 mL 锥形瓶中,减压浓缩干后,加入 50 mL 冷甲醇 在5 ℃ 左右进行超声波中振荡 2 h ,经 0.5μm 滤膜过滤,滤液待测。 C.4.1.2 色谱条件 a. 色谱柱:C18, 0.4 cm × 25 cm b. 流动相:15 % CH3CN 40 % CH3OH 45 % H2O(用 H3PO4 调 pH 至 4.0) c. 检测器:UV 254 nm × 0.1 AUFS d. 进样量:10μL e. 流速:0.7 mL/min C.4.1.3 标准样品测定 在上述色谱条件下,吸取生长素标样溶液10μL进样分析,得到GA3、IAA色谱图,记录各组分保留时间和峰面积。重复进样三次,取各组分峰面积平均值。 C.4.1.4 试样溶液测定 在同一色谱条件下,吸取试样溶液 10μL 进行分析,以外标法计算样品中各组分含量。 C.4.1.5 计算外标法定量 按(3)式 计算
式中: ρ1 — 样品中生长素的总量(mg/L) ρi — 样品中第 i 种生长素的含量(mg/L) V1 — 样品量(mL) V2 — 样品定容体积(mL) C.4.2 细胞分裂素的测定 C.4.2.1 试样制备 按C.4.1.1 的规定执行。 C.4.2.2 色谱条件 a. 色谱柱: C18, 0.4 cm × 25 cm b. 流动相:15 % CH3CN 25 % CH3OH 60 % H2O(用 H3PO4 调 pH 至 3.5) c. 检测器:UV 254 nm ×0.1 AUFS d. 进样量:20μL e. 流速:0.7 mL/min C.4.2.3 标准样品测定 按 C.4.1.3 的规定执行。 C.4.2.4 试样溶液测定 按 C.4.1.4 的规定执行。 C.4.2.5 计算外标法定量 按(4)式 计算
……(4) 式中: ρ2 — 样品中细胞分裂素的总量(mg/L) ρi — 样品中第i种细胞分裂素的含量(mg/L) V1 — 样品量(mL) V2 — 样品定容体积(mL) C.5 植物激素的总量 植物激素的总量为植物生长激素与细胞分裂素之和。 按(5)式计算
……(5) 式中: ρ — 植物激素的总量(mg/L) ρ1 — 植物生长激素的总量(mg/L) ρ2 — 细胞分裂素的总量(mg/L)
附 录 D D.1 原理试剂 仪器设备 见 GB/T 17419-1998 4.1.1,4.1.2,4.1.3。 D.2 分析步骤 D.2.1 试样溶液的制备 取试样(发酵液)2.0 mL 于 10 mL 离心管中,加入 5 % 磺基水杨酸钠 2.0 mL ,混匀,放置 1 h ,使蛋白质沉淀。再加入 EDTA 溶液 1.0 mL 和盐酸溶液 1.0 mL ,离心机离心 15 min ,取上清液 1 .0 mL 于 5 mL 的容量瓶中,蒸干,用1.0 mL(pH 2.2 )的缓冲液溶解,待测。 D.2.2 试样空白溶液的制备 空白试样溶液除不加试样外,用相同试剂溶液,按 D.2.1 规定的步骤进行。 D.2.3 测定 准确吸取 0.20 mL 混合氨基酸标准液,用 pH 2.2 的柠檬酸钠缓冲液稀释至适当浓度,作为上机测定的氨基酸标准,用氨基酸自动分析仪以外标法测定试样溶液氨基酸含量。 D.2.4 计算外标法定量 按式(6)计算:
式中: ρ — 样品中游离氨基酸总量(mg/L) ni — 进样体积 V3 中第 i 种氨基酸的量(nmol) Mi — 第 i 种氨基酸分子量 mi — 进样体积 V3 中第 i 种氨基酸的质量(ng) V1 — 样品量(mL) V2 — 样品定容体积(mL) V3 — 进样体积(μL) D.2.5 允许差 取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于 10.0 mg/L 。
附 录 E E.1 原理 发酵液中有机酸主要有:柠檬酸,琥珀酸,苹果酸,奎尼酸,乙酸等。这些有机酸溶于水,因其分子结构不同,在反相C18柱上保留的时间不同。通过调节流动相的 pH 值,可使几种有机酸依次分离。 E.2 试剂 柠檬酸,琥珀酸,苹果酸,奎尼酸,乙酸,均为分析纯。水重蒸并经 0.45μm 滤膜过滤。磷酸:优级纯。 标准溶液制备:称取以上五种有机酸标准品各 20 mg 于 10 mL 容量瓶中,用流动相溶解并定容。 E.3 仪器 高效液相色谱仪(HPLC),具紫外检测器。 E.4 样品处理 取发酵液样品 10.00 mL 于 100 mL 容量瓶中,用流动相(见 E.5)稀释并定容,摇匀后经 0.45 μm 滤膜过滤,滤液待测。 E.5 色谱条件: 色谱柱:C18, 0.4 cm×25 cm 流动相:H2O(用 H3PO4 调 pH 至 3.5) 流速:0.8 mL/min 进样量:10μL 检测器:UV 214 nm × 0.1 AUFS E.6 标准样品测定 在上述色谱条件下,吸取标准溶液 10μL 进样分析,得到各组分色谱图,记录各组分保留时间和峰面积。重复进样三次,取各组分峰面积平均值。 E.7 试样溶液测定 在同一色谱条件下,吸取试样溶液10μL 进行分析,以外标法计算样品中各组分含量。 E.8 外标法定量 按(7)式 计算 ……(7) 式中: ρ — 样品中有机酸的总量(mg/L) ρi — 样品中第 i 种有机酸的含量(mg/L) V1 — 样品量(mL) V2 — 样品定容体积(mL) |

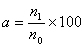
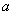 --
-- 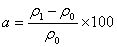
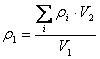
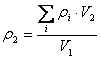
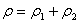
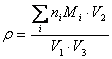 或
或